Em vários hospitais, os clínicos depararam-se com bebés com níveis de glicose extremamente elevados, perímetro cefálico reduzido e convulsões. Uma única alteração genética une agora estes sinais, remodelando a forma como as equipas interpretam a angústia metabólica nos primeiros tempos de vida.
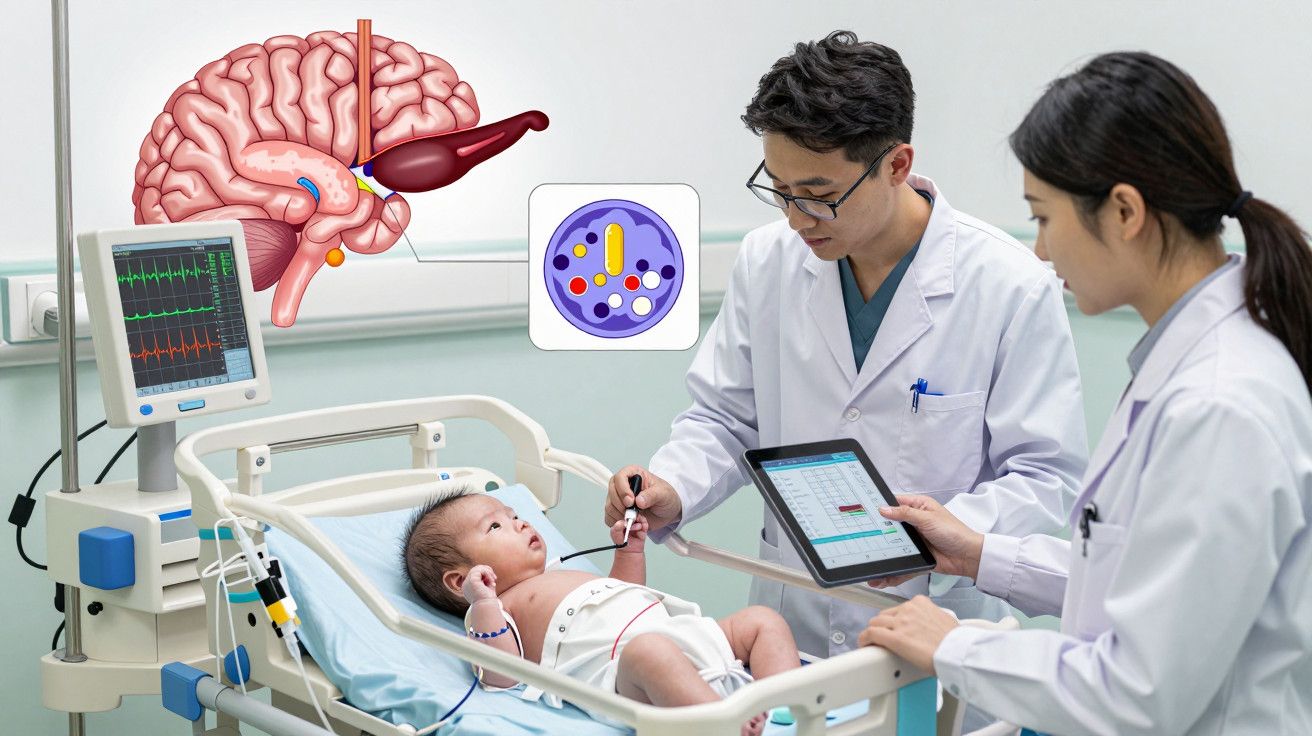
Uma falha oculta que liga o pâncreas ao cérebro
Seis bebés de três continentes desenvolveram um padrão marcante antes dos seis meses de idade, frequentemente nas primeiras semanas de vida. O açúcar no sangue disparou, exigindo insulina imediata. O crescimento da cabeça abrandou desde o nascimento, um sinal de microcefalia. Vários sofreram convulsões e atividade cerebral anómala no EEG. Testes genéticos detetaram o mesmo responsável nos seis casos: duas cópias defeituosas do gene TMEM167A, uma proteína de membrana envolvida no encaminhamento de cargas celulares.
Esta mutação corresponde ao quadro clínico conhecido por MEDS, acrónimo de “síndrome da microcefalia, epilepsia e diabetes”. Comparando com formas mais comuns de diabetes pediátrica, o percurso revela-se mais agressivo. Em cinco dos seis casos reportados, as crianças faleceram antes da adolescência. As células beta do pâncreas aparentavam estar presentes ao microscópio, mas a insulina nunca chegava à corrente sanguínea no tempo correto. Paralelamente, os neurónios em desenvolvimento tinham dificuldade em amadurecer e comunicar de forma adequada.
Uma mutação num só gene perturba as vias de transporte celular, bloqueando a libertação de insulina e travando o desenvolvimento cerebral logo nas primeiras semanas de vida.
O que faz este gene dentro da célula
O TMEM167A encontra-se na interseção entre o retículo endoplasmático e o aparelho de Golgi, os dois centros que dobram, embalam e expedem proteínas. Quando esta proteína falha, a insulina fica presa na célula, bloqueada no trânsito. O congestionamento desencadeia respostas de stress celular. As células beta, preparadas para secretar grandes volumes de hormonas após o nascimento, colapsam sob pressão e começam a morrer por apoptose. Os neurónios, igualmente dependentes de fluxo proteico rigorosamente temporizado durante a ligação dos circuitos cerebrais, também perdem terreno.
Os investigadores reproduziram a mutação em modelos de células estaminais humanas dirigidas a produzir insulina. As células beta cultivadas formaram-se, mas o trânsito insulínico entre compartimentos intracelulares era lento. À medida que o stress aumentava, as células tornaram-se anormalmente sensíveis às variações metabólicas que acompanham o nascimento, como alimentação e alterações de oxigénio.
Porque esta diabetes não é tipo 1
A diabetes tipo 1 resulta de um ataque imune progressivo que destrói as células beta ao longo de meses ou anos. Nesta forma neonatal, as células beta existem mas não funcionam. A maquinaria que embala e liberta a insulina está avariada, portanto o controlo glicémico falha mesmo com tecido pancreático intacto. Esta diferença altera o prognóstico e as perguntas que os clínicos fazem à cabeceira.
Nos casos relatados, o início concentrou-se por volta do 34.º dia de vida. Não se encontraram marcadores de autoimunidade. A imagiologia não revelou malformação pancreática. Em vez disso, foi um bloqueio celular que explicou o paradoxo: insulina dentro da célula, quase nenhuma fora. Essa assinatura aponta para genes que controlam o transporte intracelular, não para a imunidade.
A insulina é produzida, mas nunca chega à corrente sanguínea. A secreção falha muito antes de qualquer processo autoimune começar.
Pistas que os médicos podem detetar cedo
- Hiperglicemia marcada nas primeiras semanas de vida, por vezes antes da alta da maternidade
- Fraco aumento de peso, desidratação e respiração rápida apesar de apoio alimentar
- Perímetro cefálico pequeno ao nascimento ou descida rápida nos percentis
- Convulsões e padrões anormais de EEG, sugerindo um cérebro em desenvolvimento sob stress
- Necessidade imediata de insulina com pâncreas de aparência normal na imagiologia
Sinais terapêuticos iniciais—mas ainda é cedo
Como é possível reproduzir o defeito de transporte em células de laboratório, os cientistas conseguem testar potenciais intervenções em condições controladas. In vitro, compostos que atenuam o stress do retículo endoplasmático—como o ISRIB, que modula a resposta integrada ao stress, e o exendin‑4, um agonista da via GLP‑1—reduziram a vulnerabilidade celular. Estes resultados dão uma primeira pista de que estabilizar a via secretora poderá preservar a função, pelo menos temporariamente.
A realidade clínica mantém-se complexa. Os recém-nascidos têm margens de segurança estreitas, e o cérebro em desenvolvimento exige ainda maior cautela. Ensaios clínicos requereriam dosagens cuidadosas, seguimento prolongado e critérios claros de benefício. Terapia genética é uma possibilidade teórica a médio-longo prazo, mas administrar tratamento simultâneo para pâncreas e cérebro tão cedo é tarefa formidável.
| Característica | Diabetes neonatal associada ao TMEM167A | Diabetes tipo 1 clássica na infância |
| Idade de início | Perto dos 34 dias; sempre antes dos 6 meses | Normalmente após a primeira infância |
| Causa principal | Defeito de trânsito proteico, causando stress do retículo endoplasmático | Destruição autoimune das células beta |
| Estado das células beta | Presentes mas incapazes de secretar insulina | Perdidas progressivamente |
| Sinais associados | Microcefalia, convulsões, atraso do neurodesenvolvimento | Frequentemente inexistentes ao início |
| Cuidados imediatos | Terapia insulínica e monitorização neurológica | Terapia insulínica e educação |
Distribuição global e herança rara
Os casos surgiram em três continentes, sinalizando um distúrbio global mas ultra-raro. O padrão da mutação aponta para herança autossómica recessiva. Cada progenitor transporta normalmente uma cópia saudável e uma alterada. Se ambos transmitem a cópia alterada, a criança desenvolve a doença. O risco de recorrência para pais portadores é de 25% em cada gravidez.
Quando a diabetes neonatal surge, especialmente antes dos seis meses, as equipas recorrem cada vez mais a painéis genéticos ou sequenciação do exoma. Um diagnóstico rápido esclarece o prognóstico, orienta os cuidados endócrinos e neurológicos e apoia as decisões de planeamento familiar. O MEDS estava inicialmente associado a dois genes; o TMEM167A amplia este mapa e reforça a ligação entre controlo metabólico e neurodesenvolvimento.
Porque estes dois órgãos são os mais afetados
Pâncreas e cérebro partilham na vida precoce uma exigência extrema de secreção. As células beta aceleram o empacotamento de insulina no início da alimentação. Os neurónios inundam as sinapses de proteínas essenciais para a ligação dos circuitos. Ambos dependem de transporte intracelular impecável. Quando este trânsito é bloqueado, estes órgãos sentem primeiro e mais fortemente o impacto. Outros tecidos também expressam o gene, mas as suas exigências menores na infância provavelmente reduzem o efeito.
O que hospitais e famílias podem fazer agora
Os cuidados começam com insulina e vigilância rigorosa de fluidos, eletrólitos e equilíbrio ácido-base. EEG e imagiologia cerebral precoces ajudam a avaliar o risco neurológico. Ao suspeitar de causa genética, os clínicos podem envolver genética médica, neurologia, endocrinologia e nutrição. As conversas com as famílias devem incluir objetivos de cuidado, apoio ao desenvolvimento e o momento certo para exames avançados.
Critérios práticos para teste genético incluem diabetes antes dos seis meses, necessidade de insulina nos primeiros dias após o diagnóstico e quaisquer alertas neurológicos. Sempre que possível, as amostras devem entrar em registos ou estudos que acompanhem resultados e permitam reanálise à medida que o conhecimento avança. Mesmo em contextos com recursos limitados, a sequenciação dirigida a genes de diabetes neonatal pode alterar a gestão clínica.
A confirmação genética rápida reformula todo o percurso de cuidados, desde a dosagem de insulina ao planeamento do desenvolvimento e aconselhamento sobre futuras gravidezes.
Olhando para o futuro
Os cientistas já usam células estaminais pluripotentes induzidas derivadas de pacientes para criar células beta e neurónios em laboratório. Estes modelos permitem testar correção por CRISPR, pequenas moléculas chaperonas e abordagens baseadas em GLP‑1 sob o mesmo stress que as células enfrentam à nascença. Outro foco é a resposta integrada ao stress, procurando manter as células vivas tempo suficiente para recuperar alguma função.
Políticas de rastreio provavelmente não mudarão em breve, pela raridade, mas as unidades neonatais podem incluir alertas simples: diabetes de início precoce mais microcefalia justificam estudo genético. As famílias beneficiam de linguagem clara sobre hereditariedade, pesquisa de portadores para parentes e grupos de apoio com experiência em doenças endócrinas e neurogenéticas pediátricas raras.
Contextos extra que ajudam
A diabetes neonatal apresenta-se sobretudo sob duas formas. A forma transitória resolve-se em meses mas pode regressar na adolescência. A forma permanente dura toda a vida. A patologia ligada ao TMEM167A enquadra-se neste grupo permanente e traz comorbidades neurológicas graves. Esta distinção é relevante para o seguimento e expectativas quanto à resposta ao tratamento.
Pense num cenário típico: um bebé de três semanas apresenta-se com perda de peso, letargia e glicose acima de 20 mmol/L (360 mg/dL). Inicia-se insulina na unidade de cuidados intensivos neonatais. O EEG deteta descargas sugerindo atividade epilética. O perímetro cefálico está abaixo do terceiro percentil. Esta tríade deve levar a teste genético rápido em paralelo com a estabilização clínica. Tal encurta o tempo até ao diagnóstico preciso e permite à equipa planear estratégias de neuroproteção e apoio familiar desde o início.






Comentários
Ainda não há comentários. Seja o primeiro!
Deixar um comentário